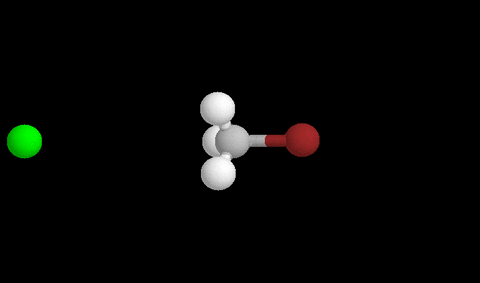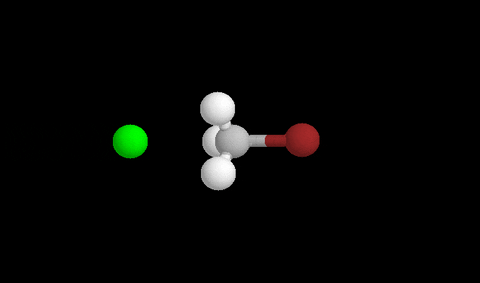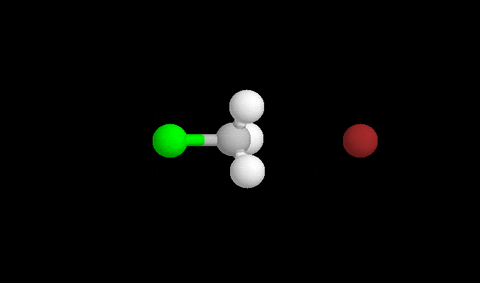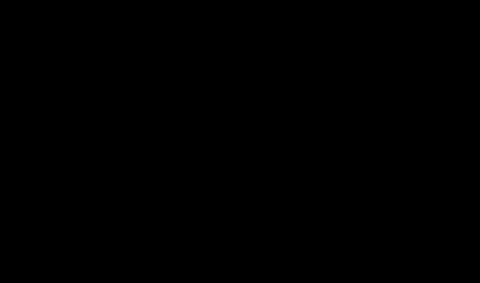
Aquí vemos la formación del estado de transición después de un choque eficaz
"LA VIDA NO ES FÁCIL PARA NINGUNO DE NOSOTROS.DEBEMOS TENER PERSEVERANCIA Y POR ENCIMA DE TODO CONFIANZA EN UNO MISMO, DEBEMOS CREER QUE SOMOS DOTADOS PARA ALGO Y QUE ESE ALGO PUEDE SER ALCANZADO"..... MARIE CURIE

sábado, 19 de octubre de 2019
ASPECTOS GENERALES DE LAS REACCIONES QUÌMICAS
A LAS REACIONES QUÍMICAS LAS PODEMOS OBSERVAR BAJO TRES ASPECTOS
No obstante existe otra gran cantidad de reacciones que son reacciones REVERSIBLES que lleganen un momento dado a un equilibrio.
Los reactivos inicialmente reaccionan dando lugar a los productos de la reacción, no obstante al formarse estos productos reaccionan entre ellos para volver a dar los reactivos...¿Cuando parará? Lo cierto es que no parará nunca, pero lo parecerá. En el momento en que la velocidad de ida y la de vuelta sea la misma, aunque a nivel macroscópico las concentraciones se mantengan constantes, a nivel molecular no pararan de reaccionar nunca.
Despues de leer la teorìa COMPLETAMOS LOS CONCEPTOS DE REVERSIBILIDAD Y EQUILIBRIO QUÍMICO CON EJEMPLOS, VIDEOS Y ANIMACIONES.
AQUÍ VA UN VIDEO QUE EXPLICA LA REVERSIBILIDAD CON LA TEORÍA DE LAS COLISIONES.
 |
TRANSFORMACIONES ENERGÉTICO CINÉTICO
REACCIONES REVERSIBLES
Tenemos la costumbre de pensar en reacciones químicas como cambios de
substancias a otras de forma permanente. Hay gran cantidad de
reacciones que son de este tipo, todas las combustiones lo son , son
irreversibles. Es decir que una vez formado el producto no se puede
volver para atras. Si quemamos madera, obtendremos carbon, pero a
partir del carbón no podremos volver a tener madera
Los reactivos inicialmente reaccionan dando lugar a los productos de la reacción, no obstante al formarse estos productos reaccionan entre ellos para volver a dar los reactivos...¿Cuando parará? Lo cierto es que no parará nunca, pero lo parecerá. En el momento en que la velocidad de ida y la de vuelta sea la misma, aunque a nivel macroscópico las concentraciones se mantengan constantes, a nivel molecular no pararan de reaccionar nunca.

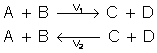
LA VELOCIDA 1 DE SÍNTESIS ES IGUAL A LA VELOCIDAD 2 DE DESCOMPOSICIÓN.
Por ello decimos que se
trata de un equilibrio dinámico.
Despues de leer la teorìa COMPLETAMOS LOS CONCEPTOS DE REVERSIBILIDAD Y EQUILIBRIO QUÍMICO CON EJEMPLOS, VIDEOS Y ANIMACIONES.
ESTE OTRO VIDEO ES MUY EXPLICATIVO, PERO VER SOLO HASTA LA CONSTANTE DE EQUILIBRIO ( tema que verán en otros años) PARA VERLO MEJOR AQUÍ
ENERGIA DE ACTIVACIÓN Y ENZIMAS
Ver esta simulacion que explica como funcionan las enzimas, sino se pueden ver ir a este LINK :
www.bionova.org.es/animbio/anim/enzimas/enzimas.swf
REACCIONES ENDOTÉRMICAS Y EXOTÉRMICAS
CUANDO SE VENCE LA BARRERA DE LA ENERGÍA DE ACTIVACIÓN, LA REACCION PROCEDE DESDE REACTIVOS A PRODUCTOS Y PUEDE SUCEDER DOS FENÓMENOS:
PRIMERO: LA ENERGÍA DE LOS PRODUCTOS ES MENOR QUE LA DE LOS REACTIVOS, EN ESTE CASO , EL EXCESO DE ENERGÍA PASA AL AMBIENTE COMO CALOR O LUZ, Y SE DICE QUE SON REACCIONES EXOTÉRMICAS.
EJEMPLOS DE ESTAS REACCIONES SON:
EL ENCENDIDO DE LAS CERILLAS,LA COMBUSTIÓN DE CUALQUIER COMBUSTIBLE,LA FORMACIÓN DE AGUA.
EN ESTE CASO LA DESACARGA ESTÁTICA DEL AIRE INICIÓ LA REACCIÓN, ES DECIR VENCIÓ LA BARRERA DE LA ENERGÍA DE ACTIVACIÓN , PERO LUEGO LA REACCIÓN CONTINUÓ SOLA, REACCIONANDO EL HIDRÓGENO CON EL OXíGENO DEL AIRE PARA DAR AGUA¡¡¡¡¡¡
SEGUNDO : LA ENERGÍA DE LOS PRODUCTOS ES MAYOR QUE LA DE LOS REACTIVOS, EN ESTE CASO SE TOMA ENERGÍA DEL AMBIENTE Y LA REACCIÓN ES
ENDOTÉRMICA.
EJEMPLOS DE REACCIONES ENDOTÉRMICAS: EL PASAJE DE LÍQUIDO A GAS , DE SÓLIDO A GAS ( SUBLIMACIÓN), LA FOTOSÍNTESIS : absorbe energía del sol para formar compuestos de alto contenido energético como la glucosa.
TAMBIÉN LAS REACCIONES ANABÓLICAS DEL METABOLISMO, O CUANDO COCINAMOS¡¡
RESUMEN GRÁFICO:
REACCIONES QUÍMICAS : energía de activación
Las reacciones químicas son re-ordenamientos de los átomos participantes en los reactivos para dar otros compuestos llamados productos.
En ese reordenamiento habrá ruptura de enlaces viejos y la formación de nuevos.
¿ Como hacen los reactivos para reordenarse ?
Lo explica el modelo de las colisiones.
Para que se produzca un reordenamiento los compuestos deben colisionar con suficiente energía y con la orientación adecuada para que sea eficaz y se formen los productos.
Si no se pudo ver la simulación de las colisiones ir a este ............Sitio
Un video que explica el modelo de colisiones
El momento en que se rompen enlaces y se forman nuevos se llama ESTADO DE TRANSICIÓN , y corresponde a un pico de energía que debe superarse para que la reacción proceda.
Un video que explica el modelo de colisiones
El momento en que se rompen enlaces y se forman nuevos se llama ESTADO DE TRANSICIÓN , y corresponde a un pico de energía que debe superarse para que la reacción proceda.
Si ese pico de energía no se alcanza , la reacción no se produce.
A ese pico de energía recibe el nombre de ENERGÍA DE ACTIVACIÓN
Esto es similar a encender una cerilla pasandolo por una superficie de vidrio, imposible que se encienda.
Todas las reacciones químicas tienen su valor de ENERGÍA DE ACTIVACIÓN que hay que superar, cuando más alta es esa energía la reacción va a ser MAS LENTA, si la energía de activación es baja la reacción es rápida y ocurre a temperatura ambiente.
Suscribirse a:
Comentarios (Atom)