"LA VIDA NO ES FÁCIL PARA NINGUNO DE NOSOTROS.DEBEMOS TENER PERSEVERANCIA Y POR ENCIMA DE TODO CONFIANZA EN UNO MISMO, DEBEMOS CREER QUE SOMOS DOTADOS PARA ALGO Y QUE ESE ALGO PUEDE SER ALCANZADO"..... MARIE CURIE

domingo, 9 de junio de 2019
ERES MÁS DEL 90 % VACÍO
El 99,9999999 % del volumen de un átomo es espacio vacío. Si el espacio vacío de los átomos se pudiera suprimir, toda la humanidad cabría en el volumen de un terrón de azúcar

Otra comparación válida sería si el núcleo es un balón de fútbol, la corteza es la región que lo rodea en un diámetro de 30 km.
Recordar que realmente no hay vacío sino un campo de fuerzas electróstáticas ejercida por el núcleo POSITIVO hacia los electrones-NEGATIVOS que impìden que se escapen del átomo.
VIVIMOS EN UNA NUBE DE ELECTRONES

Para hacernos una idea de estas dimensiones podemos utilizar la siguiente comparación:
Si el tamaño del núcleo fuera el de un SORBETE , el tamaño de la corteza sería el de un estadio de fútbol y
el electrón sería una pulga inquieta moviéndose alrededor del estadioOtra comparación válida sería si el núcleo es un balón de fútbol, la corteza es la región que lo rodea en un diámetro de 30 km.
Recordar que realmente no hay vacío sino un campo de fuerzas electróstáticas ejercida por el núcleo POSITIVO hacia los electrones-NEGATIVOS que impìden que se escapen del átomo.
VIVIMOS EN UNA NUBE DE ELECTRONES
FORMAS DE LOS ORBITALES
LA TEORÍA CUÁNTICA
El modelo de BOHR solo explicaba matematicamente los átomos con un solo elctrón, como el Hidrógeno, el Helio+ , Li ++, etc.
Para átomos de más de un electrón la matemática del modelo no alcanzaba.
Se desarrolla entonces, el nuevo y actual modelo llamado CUÁNTICO, en el cual el electrón es considerado tanto como partícula y como onda, y por lo tanto no se puede determinar con exactitud la posición y la energía del mismo simultaneamente.
Solo existen zonas de probabilidades alrededor del núcleo llamadas ORBITALES.
En estas animaciones se muestran cómo se disponen los electrones en esas zonas llamadas orbitales.
En estas animaciones se muestran cómo se disponen los electrones en esas zonas llamadas orbitales.
El LINK de esta simulación es : http://herramientas.educa.madrid.org/tabla/anim/configuracion4.swf
LAS HUELLAS DACTILARES DE LOS ELEMENTOS
 Los espectros atómicos de absorción u emisión son las huellas dactilares de los átomos. Sirven para identificarlos.En este video se explica como se forman los espectros de emisión u absorción.
Los espectros atómicos de absorción u emisión son las huellas dactilares de los átomos. Sirven para identificarlos.En este video se explica como se forman los espectros de emisión u absorción.
En esta página : http://www.educaplus.org/sp2002/espectros/spespectro.html...................pueden encontrar los espectros de algunos de los elementos
ESPECTRO ELECTROMAGNÉTICO
Repasamos la experiencia de Rutherford
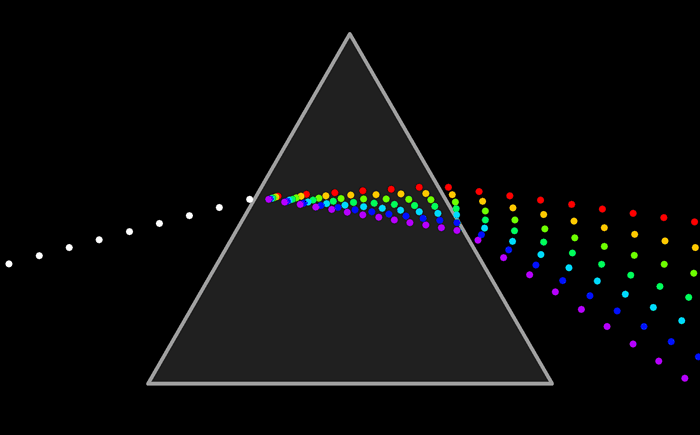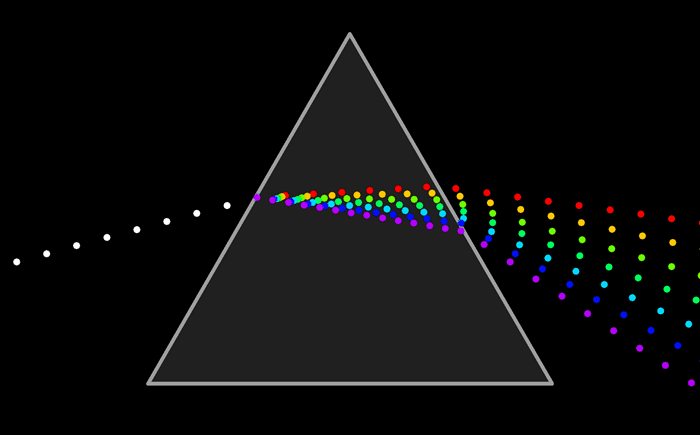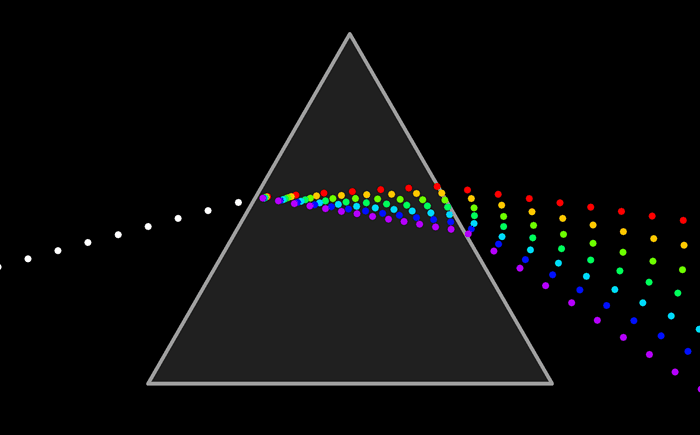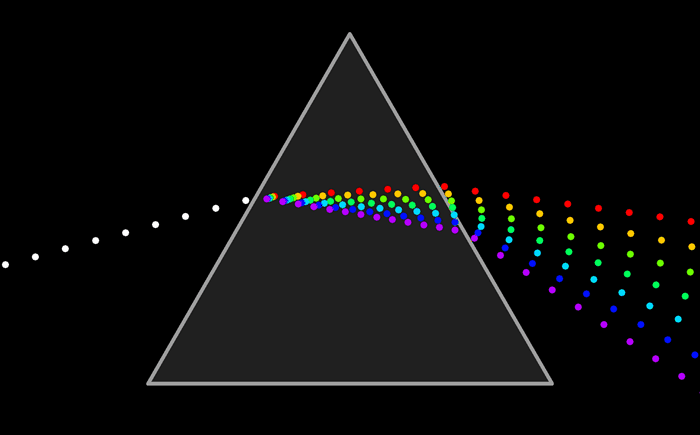
El arco iris es el espectro de la parte visible de la luz solar. Le decimos visible porque la vemos con nuestros ojos como franjas de colores.
En 1913 al poco tiempo del modelo de Rutherford, el cientifico Niels Bohr formuló un nuevo modelo atomico, basado en el átomo de Hidrógeno. Su modelo explicaba como se forman los espectros atómicos.
Pero ¿ que es un espectro ?El arco iris es el espectro de la parte visible de la luz solar. Le decimos visible porque la vemos con nuestros ojos como franjas de colores.
Antes y depues del espectro visible hay energía radiante pero que no vemos.
Son las zonas ultravioletas e infrarrojos.
El espectro completo de la energía radiante puede representarse de esta forma.
MODELO ATOMICO DE BOHR
¿ CÓMO ESTÁ FORMADO EL ESPECTRO DE LUZ ELECTROMAGNÉTICA?
Cuando esta luz radiante incide sobre cualquier átomo , este último solo absorbe algunos intervalos de energía, pasando a un estado llamado " excitado " o inestable de pocos microsegundos, volviendo a su estado previo de estabilidad llamado estado Fundamental.
Cuando vuelve emite energía que puede verse con nuestros ojos o con solo aparatos especiales y asi se registra los espectros de emisión u absorción.
Cuando vuelve emite energía que puede verse con nuestros ojos o con solo aparatos especiales y asi se registra los espectros de emisión u absorción.
El modelo atómico de Bohr
INSUFICIENCIA DEL MODELO DE RUTHERFORD
El modelo planetario en el cual los electrones giran alrededor de un núcleo positivo se contradecía con las leyes del electromagnetismo que afirmaba que un electrón en movimiento debía emitir energía continuamente en forma de radiación , con lo que llegaría un momento, en que el electrón caería sobre el núcleo y la materia se destruiría y eso debería ocurrir en un tiempo muy breve. Ver el video:
RUTHERFORD
Rutherford , partiendo de la idea del átomo de Thomson realizó una experiencia de bombardear una fina lámina de oro con partículas cargadas positivamente llamadas rayos alfa y sucedió lo siguiente:
El link de esta animación es : http://www.eis.uva.es/~qgintro/atom/imagenes/modelo_rutherford2.swf
El link de esta animación es : http://www.eis.uva.es/~qgintro/atom/imagenes/modelo_rutherford2.swf
Observó que la mayoría de los rayos atravezaban la lámina sin desviarse indicando que hay espacio vacío en el átomo y unos pocos rebotaban o se desviaban. Los que rebotaban es porque chocaban con el núcleo.
Entonces concluyó que el átomo es divisible en un centro positivo y una corteza negativa, donde giran los electrones. Entre el núcleo y la corteza hay mucho espacio vacío.
En este video se puede ver en que consistió uno de los experimentos más famoso de la física.
Algunas imágenes representativas de este modelo encontradas en la WEB, este modelo es conocido como MODELO PLANETARIO del átomo.
JOHN THOMSON
 Con Thomson
, descubridor de los electrones, el átomo tiene cargas positivas y negativas, entonces propuso un modelo de átomo, el cual era representado como una esfera compacta
cargada positivamente, en la cual se insertan los electrones cuya carga total
es igual a la carga de la esfera positiva, así el conjunto seria neutro. Este
modelo se llamó '' Budín de pasas ''
Con Thomson
, descubridor de los electrones, el átomo tiene cargas positivas y negativas, entonces propuso un modelo de átomo, el cual era representado como una esfera compacta
cargada positivamente, en la cual se insertan los electrones cuya carga total
es igual a la carga de la esfera positiva, así el conjunto seria neutro. Este
modelo se llamó '' Budín de pasas ''Aquí se muestra varias representaciones de su idea atómica encontrada en la WEB.

JOHN DALTON
-->

 Para Dalton, cada elemento está formado por una clase de átomos distintos
en sus propiedades a los átomos de los demás elementos y, justamente, es esta
distinción lo que separa un elemento de otro y los hace diferentes. Así, asignó a cada elemento conocido un
símbolo distinto ( en forma de círculos),lo que se llama su símbolo químico que luego, con posterioridad, ha ido cambiando hasta
llegar a los modernos símbolos químicos actuales.
Para Dalton, cada elemento está formado por una clase de átomos distintos
en sus propiedades a los átomos de los demás elementos y, justamente, es esta
distinción lo que separa un elemento de otro y los hace diferentes. Así, asignó a cada elemento conocido un
símbolo distinto ( en forma de círculos),lo que se llama su símbolo químico que luego, con posterioridad, ha ido cambiando hasta
llegar a los modernos símbolos químicos actuales.
La combinación de esos círculos representan las distintas moléculas

 Dalton sostenía la indivisibilidad del átomo, y esta idea se la puede representar con las siguientes imágenes atómicas encontradas en la WEB
Dalton sostenía la indivisibilidad del átomo, y esta idea se la puede representar con las siguientes imágenes atómicas encontradas en la WEB

 Para Dalton, cada elemento está formado por una clase de átomos distintos
en sus propiedades a los átomos de los demás elementos y, justamente, es esta
distinción lo que separa un elemento de otro y los hace diferentes. Así, asignó a cada elemento conocido un
símbolo distinto ( en forma de círculos),lo que se llama su símbolo químico que luego, con posterioridad, ha ido cambiando hasta
llegar a los modernos símbolos químicos actuales.
Para Dalton, cada elemento está formado por una clase de átomos distintos
en sus propiedades a los átomos de los demás elementos y, justamente, es esta
distinción lo que separa un elemento de otro y los hace diferentes. Así, asignó a cada elemento conocido un
símbolo distinto ( en forma de círculos),lo que se llama su símbolo químico que luego, con posterioridad, ha ido cambiando hasta
llegar a los modernos símbolos químicos actuales.La combinación de esos círculos representan las distintas moléculas

 Dalton sostenía la indivisibilidad del átomo, y esta idea se la puede representar con las siguientes imágenes atómicas encontradas en la WEB
Dalton sostenía la indivisibilidad del átomo, y esta idea se la puede representar con las siguientes imágenes atómicas encontradas en la WEB
Postulados de la teoría de DALTON ( para el final )
REALIDAD versus APARIENCIA : EL ÁTOMO
Apariencia versus realidad : este es el dilema populsor del pensamiento científico.
Existe una realidad inmutable, permanente que se contrapone al fenómeno de la apariencia de cambio. A esa realidad se la llamó átomo, en griego a significa no, y tomos cortar, asi el vocablo átomos significa lo que no puede ser cortado.
Para el año 400 a. de C. Demócrito y Leucipo propusieron la primera teoría atómica llamada la "Discontinuidad de la Materia". Esta consistió en que la materia se podía dividir indeterminadamente en partículas cada vez más pequeñas hasta obtener unas diminutas e indivisibles, a las que Demócrito llamó átomos. Así había átomos de oro, de agua, aire, rocas, etc.
En cambio, Aristóteles
suponía que la materia era continua y que estaba formada por una
sustancia única llamada materia, lamentablemente prevalecieron estas últimas ideas por
mucho tiempo, prácticamente por más de 2000 años , debido en parte a la influencia de la iglesia cristiana que no aceptaba
la visión materialista de que cada cosa, incluido el ser humano podría ser
descompuesto en átomos, pues entraba en contradicción con la creencia
de un Dios creador de los cuerpos y del alma humana
.
Al dividir una muestra de materia en trozos cada vez más pequeños,
finalmente se encuentra una unidad básica que no puede ser dividida sin cambiar la naturaleza
del elemento.
Esta unidad básica se llama Átomo.
Un átomo es la partícula más pequeña que
puede existir de un elemento conservando las propiedades de dicho elemento.
Suscribirse a:
Comentarios (Atom)