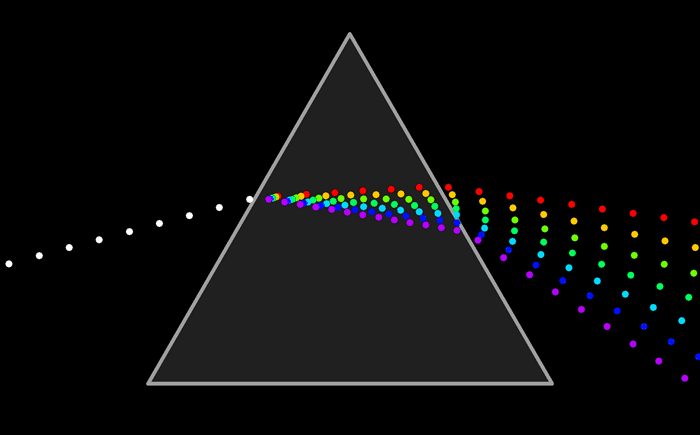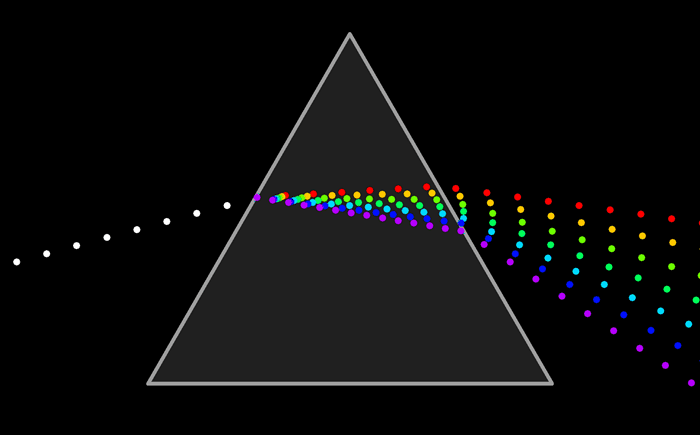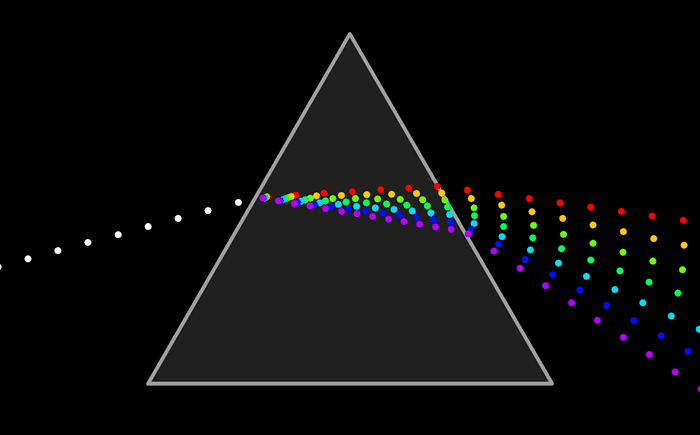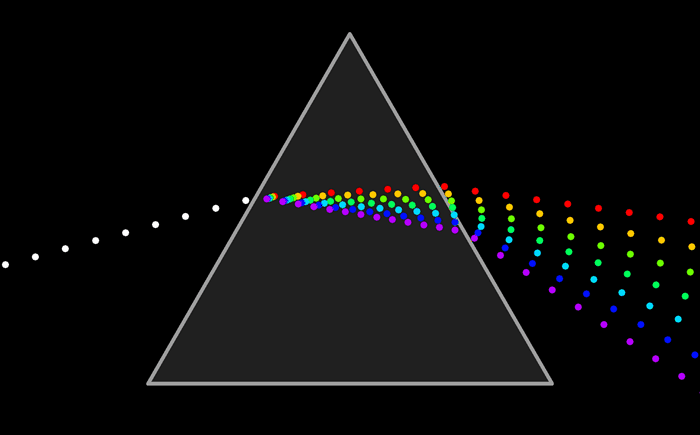
Como resumen de los tres enlaces estudiados ir a esta animación que reúne las caracteristicas de cada una.
https://www.mhe.es/bachillerato/fisica_quimica/844816962X/archivos/media/esp/unidad_2/2ani_U.2.swf
aqui va dos teorías sobre enlaces químicos para estudiar
"LA VIDA NO ES FÁCIL PARA NINGUNO DE NOSOTROS.DEBEMOS TENER PERSEVERANCIA Y POR ENCIMA DE TODO CONFIANZA EN UNO MISMO, DEBEMOS CREER QUE SOMOS DOTADOS PARA ALGO Y QUE ESE ALGO PUEDE SER ALCANZADO"..... MARIE CURIE

jueves, 20 de junio de 2019
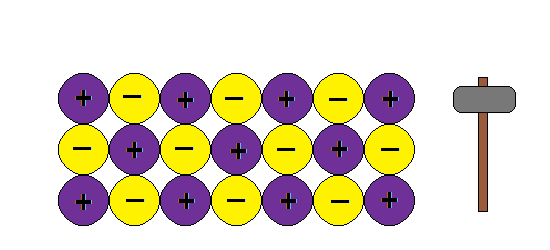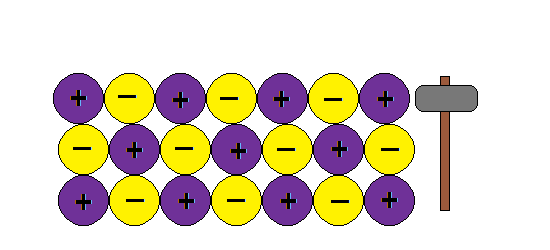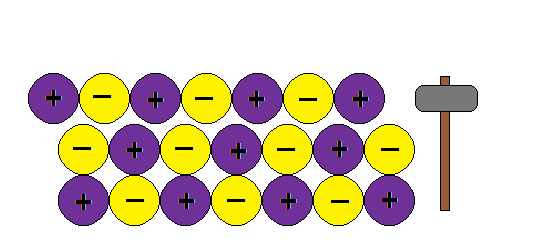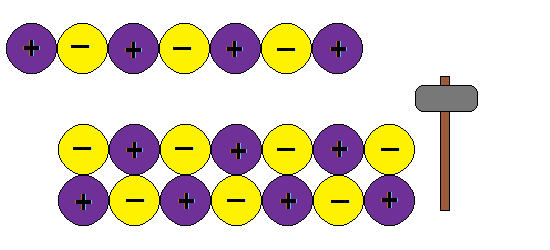
UNIÓN METÁLICA
La unión metálica es un tipo de unión en donde los átomos del metal están inmersos en una nube de electrones deslocalizados impartiendo todas las propiedades características de los metales. Ver el apunte.
Aquí va algunas imagenes de Internet para entender la estructura metálica:
Podemos imaginar la unión metálica como una red de iones positivos entre los cuales circulan electrones.Al moverse los electrones libres actúan como un material ligante manteniendo así la estructura y produciendo las propiedades características de los metales: brillo, conductividad térmica y electrica, ductilidad etc
Como explica este modelo la ductilidad de los metales, o sea la capacidad de formar hilos o alambres sin romper la estructura:???
¿ Porque al golpear granos de sal se rompen y los metales no ?
En cambio si aplicamos una fuerza en un metal , la nube de electrones mantiene la estructura de la red y no rompe.
ENLACE COVALENTE
DIVERTIDA ANIMACIÓN QUE EXPLICA EL ENLACE COVALENTE APOLAR
UNA ANIMACIÓN INTERESANTE DEL ENLACE COVALENTE DEL AGUA Y COMO SE COMPARTEN LOS ELECTRONES ENTRE EL OXÍGENO Y LOS HIDRÓGENOS
EL ENLACE COVALENTE SE PRODUCE POR EL SOLAPAMIENTO DE NUBES ELECTRÓNICAS LLAMADAS ORBITALES .HAY DOS TIPOS DE ENLACE COVALENTES.
LOS DISTINTOS TIPOS DE UNIONES DEPENDEN DE LOS VALORES DE ELECTRONEGATIVIDADES DE LOS ÁTOMOS PARTICIPANTES, QUE PERMITEN DESDE PERDER COMPLETAMENTE LOS ELECTRONES HASTA COMPARTIRLOS EQUITATIVAMENTE PASANDO POR EL ENLACE COVALENTE POLAR.
EXCELENTE ANIMACIÓN ,:http://www.educaplus.org/swf/qui_enlaceq_p.swf DONDE SE OBSERVAN COMO AL VARIAR LAS ELECTRONEGATIVIDADES LAS NUBES ELECTRÓNICAS SE DESPLAZAN HACIA EL ÁTOMO MÁS ELECTRONEGATIVO.
UNIÓN IÓNICA formación de celdas iónicas
Cuando los átomos se unen por unión iónica forman compuestos no moleculares llamados celdas iónicas, estructuras formadas por cationes y aniones unidos de tal manera que forman una estructura tridimensional o red característica.
En estos enlaces se puede visualizar la formación de redes :
http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4quincena8/animaciones8/enlace_ionico.swf
y aqui otro sitio :
http://www3.gobiernodecanarias.org/medusa/lentiscal/1-CDQuimica-TIC/FlashQ/EnlaceQ/enlaceionico.swf
En estos enlaces se puede visualizar la formación de redes :
http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4quincena8/animaciones8/enlace_ionico.swf
y aqui otro sitio :
http://www3.gobiernodecanarias.org/medusa/lentiscal/1-CDQuimica-TIC/FlashQ/EnlaceQ/enlaceionico.swf
 Estos compuestos no son moléculas, sino redes iónicas , compuestos duros de elevado punto de fusión y ebullición , que al estado sólido no conducen la corriente eléctrica , pero si lo hacen al estado fundido.
Estos compuestos no son moléculas, sino redes iónicas , compuestos duros de elevado punto de fusión y ebullición , que al estado sólido no conducen la corriente eléctrica , pero si lo hacen al estado fundido.Al estado fundido los electrones pueden movilizarse a través de los iones libres, como lo indica esta imagen:
Una divertida animación que caracteriza el enlace iónico
sábado, 15 de junio de 2019
Para el miércoles 20 descargar estos apuntes y traer a la clase ¡¡
EMPEZAMOS CON LA TEORÍA DE UNIONES QUÍMICAS
El concepto de densidad , mirar este video:https://www.facebook.com/QuimicanaArea/videos/1923992807833112/?fref=mentions
EMPEZAMOS CON LA TEORÍA DE UNIONES QUÍMICAS
El concepto de densidad , mirar este video:https://www.facebook.com/QuimicanaArea/videos/1923992807833112/?fref=mentions
domingo, 9 de junio de 2019
ERES MÁS DEL 90 % VACÍO
El 99,9999999 % del volumen de un átomo es espacio vacío. Si el espacio vacío de los átomos se pudiera suprimir, toda la humanidad cabría en el volumen de un terrón de azúcar

Otra comparación válida sería si el núcleo es un balón de fútbol, la corteza es la región que lo rodea en un diámetro de 30 km.
Recordar que realmente no hay vacío sino un campo de fuerzas electróstáticas ejercida por el núcleo POSITIVO hacia los electrones-NEGATIVOS que impìden que se escapen del átomo.
VIVIMOS EN UNA NUBE DE ELECTRONES

Para hacernos una idea de estas dimensiones podemos utilizar la siguiente comparación:
Si el tamaño del núcleo fuera el de un SORBETE , el tamaño de la corteza sería el de un estadio de fútbol y
el electrón sería una pulga inquieta moviéndose alrededor del estadioOtra comparación válida sería si el núcleo es un balón de fútbol, la corteza es la región que lo rodea en un diámetro de 30 km.
Recordar que realmente no hay vacío sino un campo de fuerzas electróstáticas ejercida por el núcleo POSITIVO hacia los electrones-NEGATIVOS que impìden que se escapen del átomo.
VIVIMOS EN UNA NUBE DE ELECTRONES
FORMAS DE LOS ORBITALES
LA TEORÍA CUÁNTICA
El modelo de BOHR solo explicaba matematicamente los átomos con un solo elctrón, como el Hidrógeno, el Helio+ , Li ++, etc.
Para átomos de más de un electrón la matemática del modelo no alcanzaba.
Se desarrolla entonces, el nuevo y actual modelo llamado CUÁNTICO, en el cual el electrón es considerado tanto como partícula y como onda, y por lo tanto no se puede determinar con exactitud la posición y la energía del mismo simultaneamente.
Solo existen zonas de probabilidades alrededor del núcleo llamadas ORBITALES.
En estas animaciones se muestran cómo se disponen los electrones en esas zonas llamadas orbitales.
En estas animaciones se muestran cómo se disponen los electrones en esas zonas llamadas orbitales.
El LINK de esta simulación es : http://herramientas.educa.madrid.org/tabla/anim/configuracion4.swf
LAS HUELLAS DACTILARES DE LOS ELEMENTOS
 Los espectros atómicos de absorción u emisión son las huellas dactilares de los átomos. Sirven para identificarlos.En este video se explica como se forman los espectros de emisión u absorción.
Los espectros atómicos de absorción u emisión son las huellas dactilares de los átomos. Sirven para identificarlos.En este video se explica como se forman los espectros de emisión u absorción.
En esta página : http://www.educaplus.org/sp2002/espectros/spespectro.html...................pueden encontrar los espectros de algunos de los elementos
ESPECTRO ELECTROMAGNÉTICO
Repasamos la experiencia de Rutherford
El arco iris es el espectro de la parte visible de la luz solar. Le decimos visible porque la vemos con nuestros ojos como franjas de colores.
En 1913 al poco tiempo del modelo de Rutherford, el cientifico Niels Bohr formuló un nuevo modelo atomico, basado en el átomo de Hidrógeno. Su modelo explicaba como se forman los espectros atómicos.
Pero ¿ que es un espectro ?El arco iris es el espectro de la parte visible de la luz solar. Le decimos visible porque la vemos con nuestros ojos como franjas de colores.
Antes y depues del espectro visible hay energía radiante pero que no vemos.
Son las zonas ultravioletas e infrarrojos.
El espectro completo de la energía radiante puede representarse de esta forma.
MODELO ATOMICO DE BOHR
¿ CÓMO ESTÁ FORMADO EL ESPECTRO DE LUZ ELECTROMAGNÉTICA?
Cuando esta luz radiante incide sobre cualquier átomo , este último solo absorbe algunos intervalos de energía, pasando a un estado llamado " excitado " o inestable de pocos microsegundos, volviendo a su estado previo de estabilidad llamado estado Fundamental.
Cuando vuelve emite energía que puede verse con nuestros ojos o con solo aparatos especiales y asi se registra los espectros de emisión u absorción.
Cuando vuelve emite energía que puede verse con nuestros ojos o con solo aparatos especiales y asi se registra los espectros de emisión u absorción.
El modelo atómico de Bohr
INSUFICIENCIA DEL MODELO DE RUTHERFORD
El modelo planetario en el cual los electrones giran alrededor de un núcleo positivo se contradecía con las leyes del electromagnetismo que afirmaba que un electrón en movimiento debía emitir energía continuamente en forma de radiación , con lo que llegaría un momento, en que el electrón caería sobre el núcleo y la materia se destruiría y eso debería ocurrir en un tiempo muy breve. Ver el video:
RUTHERFORD
Rutherford , partiendo de la idea del átomo de Thomson realizó una experiencia de bombardear una fina lámina de oro con partículas cargadas positivamente llamadas rayos alfa y sucedió lo siguiente:
El link de esta animación es : http://www.eis.uva.es/~qgintro/atom/imagenes/modelo_rutherford2.swf
El link de esta animación es : http://www.eis.uva.es/~qgintro/atom/imagenes/modelo_rutherford2.swf
Observó que la mayoría de los rayos atravezaban la lámina sin desviarse indicando que hay espacio vacío en el átomo y unos pocos rebotaban o se desviaban. Los que rebotaban es porque chocaban con el núcleo.
Entonces concluyó que el átomo es divisible en un centro positivo y una corteza negativa, donde giran los electrones. Entre el núcleo y la corteza hay mucho espacio vacío.
En este video se puede ver en que consistió uno de los experimentos más famoso de la física.
Algunas imágenes representativas de este modelo encontradas en la WEB, este modelo es conocido como MODELO PLANETARIO del átomo.
JOHN THOMSON
 Con Thomson
, descubridor de los electrones, el átomo tiene cargas positivas y negativas, entonces propuso un modelo de átomo, el cual era representado como una esfera compacta
cargada positivamente, en la cual se insertan los electrones cuya carga total
es igual a la carga de la esfera positiva, así el conjunto seria neutro. Este
modelo se llamó '' Budín de pasas ''
Con Thomson
, descubridor de los electrones, el átomo tiene cargas positivas y negativas, entonces propuso un modelo de átomo, el cual era representado como una esfera compacta
cargada positivamente, en la cual se insertan los electrones cuya carga total
es igual a la carga de la esfera positiva, así el conjunto seria neutro. Este
modelo se llamó '' Budín de pasas ''Aquí se muestra varias representaciones de su idea atómica encontrada en la WEB.

Suscribirse a:
Entradas (Atom)