Como resumen de los tres enlaces estudiados ir a esta animación que reúne las caracteristicas de cada una.
https://www.mhe.es/bachillerato/fisica_quimica/844816962X/archivos/media/esp/unidad_2/2ani_U.2.swf
aqui va dos teorías sobre enlaces químicos para estudiar
"LA VIDA NO ES FÁCIL PARA NINGUNO DE NOSOTROS.DEBEMOS TENER PERSEVERANCIA Y POR ENCIMA DE TODO CONFIANZA EN UNO MISMO, DEBEMOS CREER QUE SOMOS DOTADOS PARA ALGO Y QUE ESE ALGO PUEDE SER ALCANZADO"..... MARIE CURIE

jueves, 20 de junio de 2019
UNIÓN METÁLICA
La unión metálica es un tipo de unión en donde los átomos del metal están inmersos en una nube de electrones deslocalizados impartiendo todas las propiedades características de los metales. Ver el apunte.
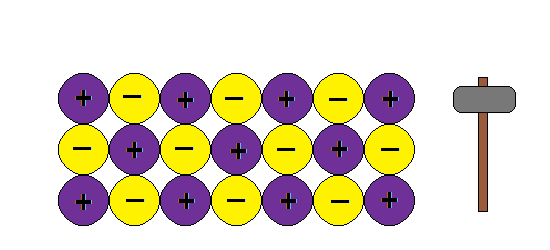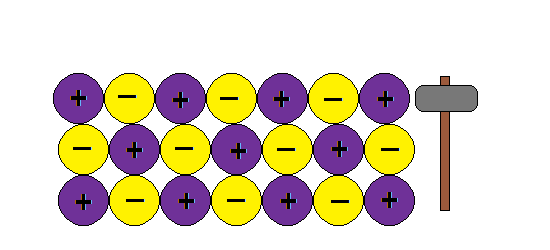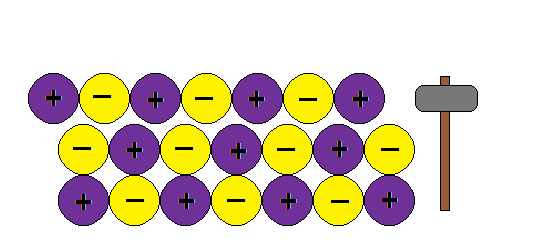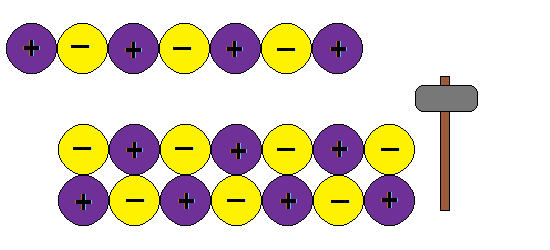
Aquí va algunas imagenes de Internet para entender la estructura metálica:
Podemos imaginar la unión metálica como una red de iones positivos entre los cuales circulan electrones.Al moverse los electrones libres actúan como un material ligante manteniendo así la estructura y produciendo las propiedades características de los metales: brillo, conductividad térmica y electrica, ductilidad etc
Como explica este modelo la ductilidad de los metales, o sea la capacidad de formar hilos o alambres sin romper la estructura:???
¿ Porque al golpear granos de sal se rompen y los metales no ?
En cambio si aplicamos una fuerza en un metal , la nube de electrones mantiene la estructura de la red y no rompe.
ENLACE COVALENTE
DIVERTIDA ANIMACIÓN QUE EXPLICA EL ENLACE COVALENTE APOLAR
UNA ANIMACIÓN INTERESANTE DEL ENLACE COVALENTE DEL AGUA Y COMO SE COMPARTEN LOS ELECTRONES ENTRE EL OXÍGENO Y LOS HIDRÓGENOS
EL ENLACE COVALENTE SE PRODUCE POR EL SOLAPAMIENTO DE NUBES ELECTRÓNICAS LLAMADAS ORBITALES .HAY DOS TIPOS DE ENLACE COVALENTES.
LOS DISTINTOS TIPOS DE UNIONES DEPENDEN DE LOS VALORES DE ELECTRONEGATIVIDADES DE LOS ÁTOMOS PARTICIPANTES, QUE PERMITEN DESDE PERDER COMPLETAMENTE LOS ELECTRONES HASTA COMPARTIRLOS EQUITATIVAMENTE PASANDO POR EL ENLACE COVALENTE POLAR.
EXCELENTE ANIMACIÓN ,:http://www.educaplus.org/swf/qui_enlaceq_p.swf DONDE SE OBSERVAN COMO AL VARIAR LAS ELECTRONEGATIVIDADES LAS NUBES ELECTRÓNICAS SE DESPLAZAN HACIA EL ÁTOMO MÁS ELECTRONEGATIVO.
UNIÓN IÓNICA formación de celdas iónicas
Cuando los átomos se unen por unión iónica forman compuestos no moleculares llamados celdas iónicas, estructuras formadas por cationes y aniones unidos de tal manera que forman una estructura tridimensional o red característica.
En estos enlaces se puede visualizar la formación de redes :
http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4quincena8/animaciones8/enlace_ionico.swf
y aqui otro sitio :
http://www3.gobiernodecanarias.org/medusa/lentiscal/1-CDQuimica-TIC/FlashQ/EnlaceQ/enlaceionico.swf
En estos enlaces se puede visualizar la formación de redes :
http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4quincena8/animaciones8/enlace_ionico.swf
y aqui otro sitio :
http://www3.gobiernodecanarias.org/medusa/lentiscal/1-CDQuimica-TIC/FlashQ/EnlaceQ/enlaceionico.swf
 Estos compuestos no son moléculas, sino redes iónicas , compuestos duros de elevado punto de fusión y ebullición , que al estado sólido no conducen la corriente eléctrica , pero si lo hacen al estado fundido.
Estos compuestos no son moléculas, sino redes iónicas , compuestos duros de elevado punto de fusión y ebullición , que al estado sólido no conducen la corriente eléctrica , pero si lo hacen al estado fundido.Al estado fundido los electrones pueden movilizarse a través de los iones libres, como lo indica esta imagen:
Una divertida animación que caracteriza el enlace iónico
Suscribirse a:
Comentarios (Atom)