DIPOLOS PERMANENTES
Ya hemos estudiado la diferencia entre enlaces covalentes apolares y polares
Ya hemos estudiado la diferencia entre enlaces covalentes apolares y polares
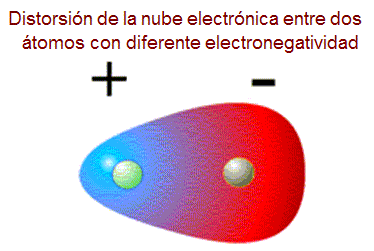
En la polares , debido a la distribución asimétricas de los electrones alrededor del enlace,hay una densidad más negativa de un lado de la molécula neutra y otra más positiva del otro lado creándose lo que se llama un DIPOLO ELÉCTRICO
que se puede representar así:
Este dipolo permanente puede interaccionar con otras moléculas polares de la siguiente manera:
Se llama interacción : DIPOLO PERMANENTE-DIPOLO PERMANTE o simplemente DIPOLO-DIPOLO
Tambien tenemos : dipolo permanente -dipolo inducido
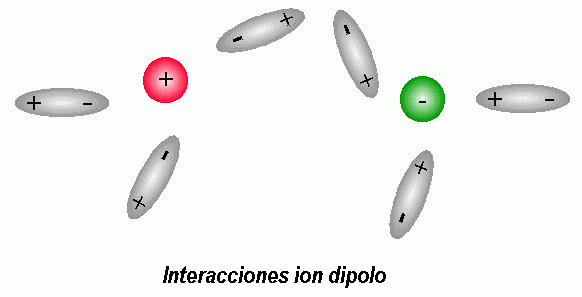
INTERACCIÓN CARGA-DIPOLO permanente
Este tipo de interación es la responsable de la solubilidad de las sales en agua.
DIPOLOS INDUCIDOS O MOMENTÁNEOS o
FUERZAS DE LONDON
Se debe al movimiento de los electrones en torno a los núcleos. Ese movimiento de los electrones provoca asimetrías en su distribución espacial que duran solamente un instante. Durante ese pequeño intervalo hay una parte de la molécula (o del átomo en caso de los gases nobles) con exceso de carga negativa y otra parte en la que hay “falta” de electrones y, por tanto, un exceso de carga positiva. Se trata de un
Dipolo instantáneo
Otra forma de inducir un dipolo es cuando una partícula cargada se acerca a una molécula apolar
Las moléculas con momento dipolar igual a cero (apolares) no forman dipolos
permanentes pero si que pueden formar pequeños dipolos durante un corto
intervalo de tiempo (dipolos instantáneos), como se puede ver en esta animación
Se debe al movimiento de los electrones en torno a los núcleos. Ese movimiento de los electrones provoca asimetrías en su distribución espacial que duran solamente un instante. Durante ese pequeño intervalo hay una parte de la molécula (o del átomo en caso de los gases nobles) con exceso de carga negativa y otra parte en la que hay “falta” de electrones y, por tanto, un exceso de carga positiva. Se trata de un
Dipolo instantáneo
Otra forma de inducir un dipolo es cuando una partícula cargada se acerca a una molécula apolar
Los gases nobles por ejemplo se licuan porque al acercarse dos átomos se forman dipolos momentáneos de acuerdo a la siguiente animación
 RESUMEN : si bien las moléculas apolares tienen distribución simétrica de electrones , los mismos están constantemente moviendose y originan dipolos transitorios, ,momentáneos . Esto sucede con mayor intensidad si se les acerca una partícula cargada.
RESUMEN : si bien las moléculas apolares tienen distribución simétrica de electrones , los mismos están constantemente moviendose y originan dipolos transitorios, ,momentáneos . Esto sucede con mayor intensidad si se les acerca una partícula cargada.
TODAS ESTAS INTERACCIONES DONDE SE FORMAN DIPOLOS SE LLAMAN FUERZAS DE VAN DEL WAALS MUY IMPORTANTES EN BIOLOGÌA MOLECULAR.
DIPOLO PERMANENTE-DIPOLO PERMANENTE
DIPOLO PERMANENTE-CARGA
DIPOLO PERMANENTE-DIPOLO INDUCIDO
DIPOLO INDUCIDO-DIPOLO INDUCIDO







No hay comentarios:
Publicar un comentario